Từ thực phẩm chức năng đến nhà máy dược phẩm: Tiềm năng vi tảo trong y dược hiện đại
Dược phẩm sinh học ngày càng quan trọng trong điều trị nhiều bệnh, nhưng phần lớn thuốc hiện nay phải dùng đường tiêm và cần bảo quản lạnh. Điều này làm tăng chi phí, và khó triển khai ở các nước thu nhập thấp và trung bình. Một hướng tiếp cận mới là dùng vi tảo ăn được, đặc biệt là tảo xoắn (Arthrospira platensis), như một “nhà máy sống” để sản xuất và vận chuyển thuốc sinh học qua đường uống. Các nghiên cứu gần đây cho thấy vi tảo tái tổ hợp có thể tạo ra kháng thể, enzyme hoặc vaccine, sau đó được sấy khô và uống trực tiếp mà vẫn giữ hoạt tính sinh học [1, 2, 3].
Năm 2022, Jester và cộng sự đã biến đổi di truyền tảo xoắn để tế bào biểu hiện protein trị liệu với hàm lượng rất cao, chiếm tới hàng chục phần trăm khối lượng khô. Tảo xoắn được nuôi ở quy mô lớn trong hệ thống kín, sau đó sấy thành bột khô và dùng như một “viên thuốc ăn được”, trong đó các protein trị liệu được bảo vệ bên trong tế bào và chỉ giải phóng ở ruột. Nhóm nghiên cứu cho thấy tảo xoắn mang kháng thể chống Campylobacter có thể phòng bệnh trên mô hình động vật và đã qua thử nghiệm lâm sàng pha 1 an toàn trên người, ổn định ở nhiệt độ phòng [1]. Cách làm này mở ra khả năng thiết kế các “viên tảo trị liệu” uống được cho bệnh lý đường ruột, nhiễm khuẩn và cả bệnh mạn tính cần điều trị lâu dài.
Hiện nay, dược phẩm sinh học từ vi tảo được xem là một hướng phát triển mới và bền vững. Vi tảo và vi khuẩn lam có thể được chỉnh sửa bằng CRISPR để tăng cường biểu hiện gen mục tiêu trong sản xuất kháng thể, vaccine, enzyme điều trị cho cả người và thú y, với chi phí nuôi cấy thấp và yêu cầu cơ sở vật chất không quá cao (Hình 1). Cách tiếp cận này phù hợp với mô hình One Health – bảo vệ sức khỏe con người gắn với động vật và môi trường [2, 3, 4]. Điểm mạnh của vi tảo ăn được là cùng một hệ thống vừa là nhà máy sản xuất protein, vừa là phương tiện đưa thuốc qua đường tiêu hóa. Nhờ đó có thể giảm nhiều bước tinh sạch, giảm chi phí bảo quản lạnh và vận chuyển, đặc biệt hữu ích cho các nước đang phát triển [2, 3].
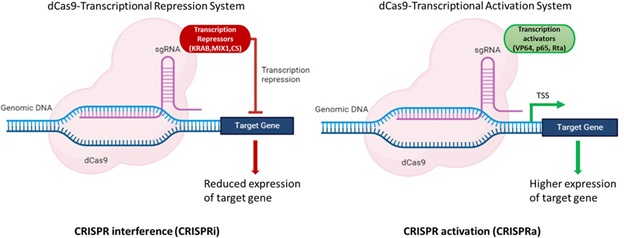
Hình 1. Hình minh họa về sự điều chỉnh biểu hiện gen mục tiêu dựa trên dead Cas9 (dCas9). Ở hệ CRISPRi, phức hợp dCas9–sgRNA được gắn với các domain ức chế phiên mã (KRAB, MIX1, CS), bám gần vùng điều hòa của gen và làm giảm biểu hiện của gen mục tiêu hoặc các gen lân cận. Ở hệ CRISPRa, dCas9–sgRNA được gắn với các domain hoạt hóa phiên mã (VP64, p65, Rta) gần vị trí bắt đầu phiên mã (TSS), giúp tăng biểu hiện gen mục tiêu và từ đó nâng cao sản lượng phân tử mong muốn [4]
Tóm lại, vi tảo ăn được – tiêu biểu là tảo xoắn – đang chuyển từ vai trò thực phẩm chức năng sang vai trò như một nhà máy sản xuất thuốc và đưa thuốc vào cơ thể qua đường uống cho dược phẩm sinh học. Vẫn còn các thách thức về chuẩn hóa mức biểu hiện protein, kiểm soát an toàn sinh học và quy định pháp lý, nhưng nhiều nhóm nghiên cứu đánh giá đây là một hướng đi rất tiềm năng cho tương lai [1, 2, 3].
Tài liệu tham khảo
- Jester BW et al. Development of spirulina for the manufacture and oral delivery of protein therapeutics. Nature Biotechnology. 2022;40(6):956–964. doi:10.1038/s41587-022-01249-7
- García-Silva I, Vimolmangkang S, Rosales-Mendoza S. Microalgae-made biopharmaceuticals and their potential role in the One Health approach. Trends in Biotechnology. 2025; doi:10.1016/j.tibtech.2025.08.018
- Goshtasbi H et al. Harnessing microalgae as sustainable cellular factories for biopharmaceutical production. Algal Research. 2023;74:103237. doi:10.1016/j.algal.2023.103237
- Patra D. CRISPR-engineered microalgae: a promising approach for the production of therapeutic proteins. Innovations in Molecular Biotechnology. 2023;1(1):1–6. doi:10.61577/imb.2023.100004.
Người đăng bài: ThS. Phan Thủy Quyên
- Bước ngoặt y học Việt Nam: Chữa khỏi ung thư máu bằng tế bào CAR-T nội địa
- Phát triển thuốc năm 2026: Khi công nghệ số thay thế thử nghiệm động vật
- Seminar học thuật: Giải mã cơ chế hoạt động của enzyme RNase III trong quá trình sinh tổng hợp miRNA ở các loài
- Giải Nobel Y học 2025: Hành trình hơn ba thập kỷ giải mã “phanh hãm” của hệ miễn dịch

